时间:2021-08-09 来源:
多年来,纳米技术一直被视为一门拥有无限潜力的科学,并已经被广泛应用于材料与制造、电子与信息技术、能源与环境、以及医学与健康领域。伴随着纳米科学技术在各行各业的普遍应用,理解纳米生物效应与安全性变得愈加重要,但相关研究却始终处于早期阶段。由于纳米材料的大小与生物大分子非常接近,因此普遍认为纳米材料能够与多种生物分子发生相互作用。就其生物学结果而言,纳米生物作用可具有正向效应和负向效应。正向纳米生物效应,可以被用于开发新的纳米药物,将给疾病诊断和治疗带来新的机遇;而负向纳米生物效应,则会对人体、生物乃至整个生态环境产生毒性,将造成严重的生物安全隐患。因此,研究纳米材料与生物系统,特别是在细胞和分子层面的作用机理,对纳米技术的正确应用至关重要。目前的纳米生物学效应研究主要聚焦于材料表界面的物化性质诱导的生物学效应,这些效应通常为纳米材料的普适性效应。但是,纳米材料进入细胞后,如何影响细胞的功能?是否能够与细胞内各种微尺度的生物分子发生相互作用?是否能够影响具体的生物分子或信号通路?不同纳米材料是否具有不同的生物靶向分子?对这些重要问题,目前还没有非常明确的答案。
2021年8月5日,中国科学院深圳先进技术研究院李红昌课题组,联合喻学锋课题组和李洋课题组合作在Nature Nanotech上发表文章 Intrinsic Bioactivity of Black Phosphorus Nanomaterials on Mitotic Centrosome Destabilization through Suppression of PLK1 Kinase ,充分发挥先进院学科交叉优势,选取黑磷纳米材料为研究模型,通过精细的细胞生物学和分子生物学研究,发现纳米材料在细胞内可通过精准靶向某个具体生物分子,以获得特定的生物效应。本研究提供了一个从分子细胞生物学维度深入研究纳米材料精准生物靶向机制的全新路径。深圳先进技术研究院副研究员邵喜明和研究助理丁智昊为论文并列第一作者,李红昌研究员,喻学锋研究员和李洋副研究员为论文共同通讯作者。

团队首先发现使用低浓度黑磷纳米材料处理细胞,能够导致细胞分裂特异停滞在细胞周期的有丝分裂M期。细胞周期是细胞分裂的基本机理。整个细胞周期分为四个时期,每次分裂都严格按照G1,S,G2,M的顺序进行,其中每个过程都受到众多信号通路的精细调控。黑磷纳米材料导致细胞周期停滞在细胞周期中时程最短的M期,意味着纳米材料对M期的某个关键细胞器或某条关键信号通路功能进行了特异干扰,因此非常可能是一种材料特异的纳米生物学效应。随后,团队对这一现象背后的机理进行了深入挖掘,发现黑磷纳米材料造成有丝分裂核心细胞器——中心体(centrosome)的分离受到阻滞。这一机制被最终确定为黑磷纳米材料导致细胞分裂M期停滞的直接原因。
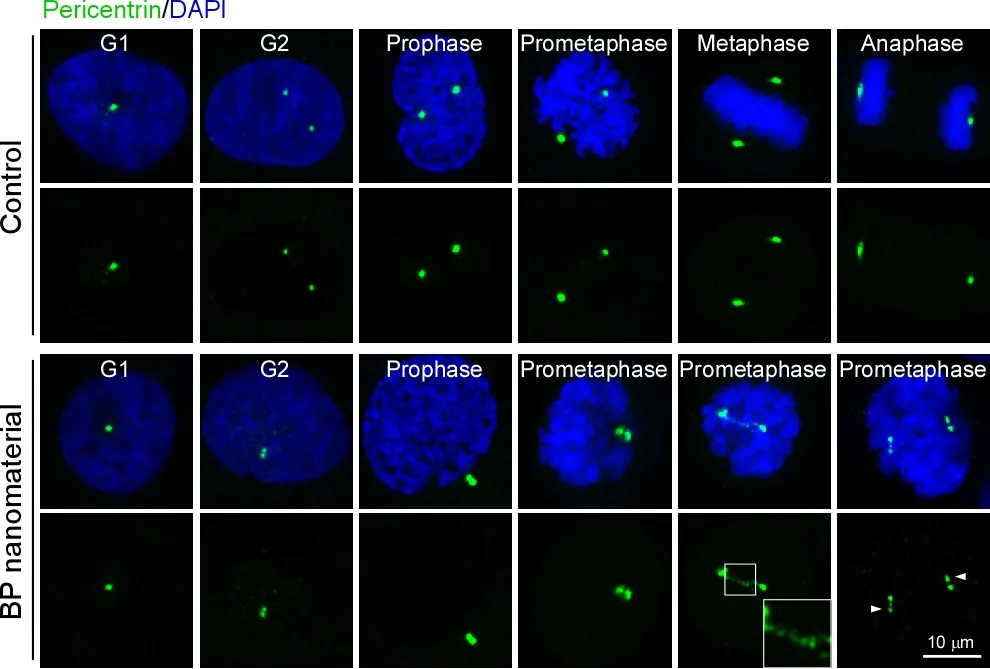
黑磷纳米材料导致的细胞周期阻断效应可以完全媲美于已经发现的靶向细胞分裂M期的特异小分子药物,因此团队进一步探索了黑磷纳米材料是否有特定的生物靶向分子。通过一系列生物化学和细胞生物学研究,团队最后确认有丝分裂激酶PLK1是黑磷纳米材料的生物效应靶点。黑磷纳米材料可以特异结合PLK1,并抑制其激酶活性,从而阻断了细胞分裂M期的正常进行。
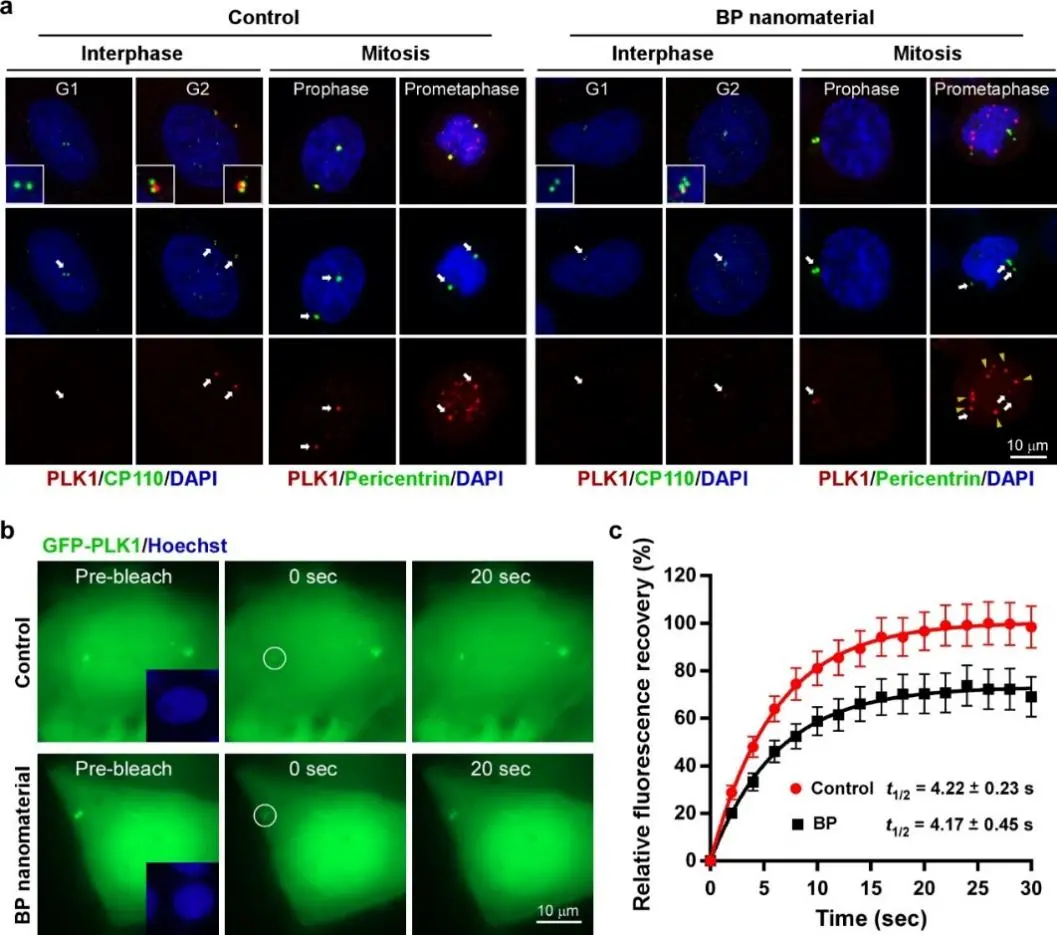
很多纳米生物学效应与纳米材料的尺寸、形状、表界面电荷等物理性质相关。本团队发现黑磷纳米材料的细胞周期阻断效应与材料的尺寸和形状无关,但与材料的水解活性密切相关。对各种磷基纳米材料的研究发现,具有较好水解活性的磷基纳米材料都表现出与黑磷相似的生物效应,而水解活性差的磷基纳米材料则没有类似效应。由于磷基纳米材料水解会产生磷酸根,因此材料表面必会吸附大量磷酸根,这与细胞内生物大分子的磷酸化修饰非常相像,而蛋白质磷酸化修饰恰好是PLK1底物蛋白与PLK1结合的必备条件,因此细胞内PLK1很可能将表面富含磷酸根的纳米材料误认为底物蛋白进行了结合,最终导致其激酶活性被这些纳米材料所抑制。
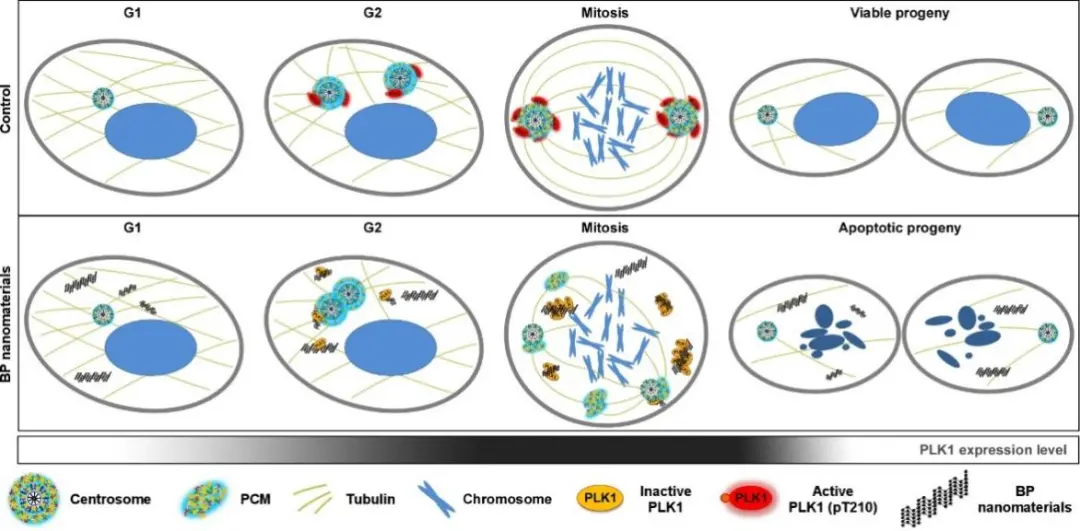 图3:黑磷纳米材料抑制细胞有丝分裂进行的分子细胞机制:黑磷纳米材料通过靶向细胞分裂关键激酶PLK1,抑制其向中心体位置的转移和活化,造成中心体正常分离被抑制,并引发中心体碎片化,进而导致多极纺锤体形成,最终抑制了细胞有丝分裂的完成。
图3:黑磷纳米材料抑制细胞有丝分裂进行的分子细胞机制:黑磷纳米材料通过靶向细胞分裂关键激酶PLK1,抑制其向中心体位置的转移和活化,造成中心体正常分离被抑制,并引发中心体碎片化,进而导致多极纺锤体形成,最终抑制了细胞有丝分裂的完成。
抑制细胞周期是理想的抗肿瘤策略。黑磷纳米材料作为一种新型PLK1抑制剂,在实验动物模型中展现出了优秀的肿瘤抑制效果。因此假以时日,黑磷纳米材料非常有可能发展成为一个临床可用的抗肿瘤纳米药物。最重要的,本项目研究结果明确展示了纳米材料能够通过精准靶向特定生物分子进而获得特异的纳米生物学效应,因此必将带动纳米领域对不同纳米材料的内在生物学效应和分子细胞机制进行广泛研究,最终为纳米精准药物的研发开辟全新路径。
原文链接:
https://www.nature.com/articles/s41565-021-00952-x